Célzott daganatterápia: EGFR-gátlás
Az epidermális növekedési faktor receptor (EGFR) gátlása az egyik legígéretesebb célzott daganatterápiás módszer. Az alábbiakban bemutatjuk az EGFR működését, szerepét különböző daganattípusokban, valamint az EGFR-gátló terápiák típusait és alkalmazási lehetőségeit. A legújabb kutatási eredmények tükrében áttekintjük, hogyan segíthetnek ezek a kezelések a rákbetegek életkilátásainak javításában.
Mi az EGFR célzott terápia?
Az EGFR (más néven ErbB1) egy 170 kDa tömegű fehérje, amely az ErbB családba tartozó transzmembrán tirozin-kináz növekedési faktor receptorok egyike.
Az EGFR aktiválódása több jelátviteli útvonalat indít be, többek között:
- Ras/mitogén-aktivált protein (MAP) kináz útvonal
- Foszfatidilinozitol-3-kináz (PI3K)/Akt útvonal
- Src családba tartozó kinázok
- STAT (signal transducers and activators of transcription) fehérjék
Ezek az útvonalak serkentik a sejtosztódást, gátolják a programozott sejthalált, elősegítik az érképződést és a daganatsejtek invázióját.
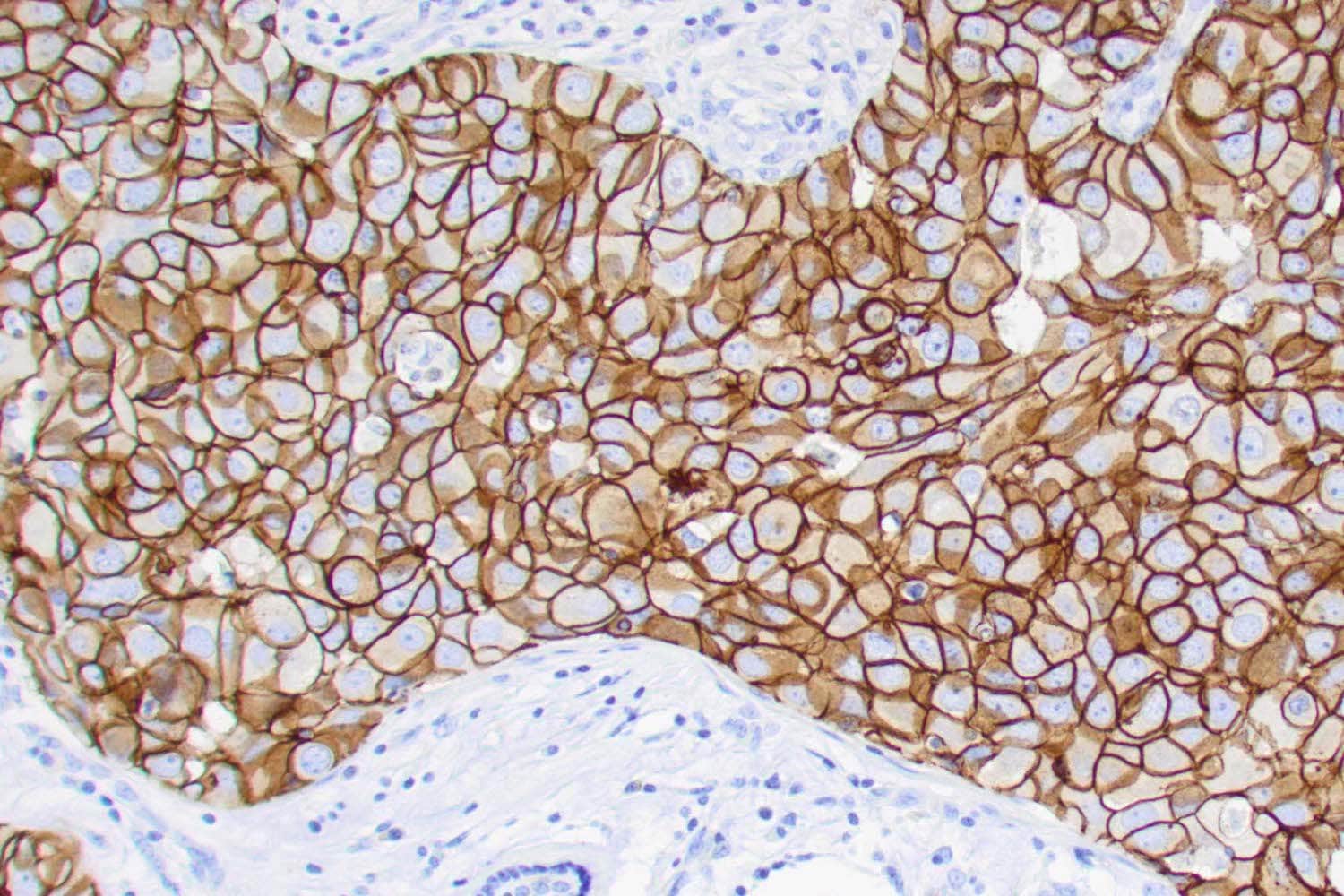
Az EGFR számos daganattípusban fokozottan expresszálódik vagy túlműködik, ami kiváló célponttá teszi a célzott terápiák számára. A növekedési faktor receptorok működésének blokkolása speciális gyógyszermolekulák segítségével történik. Ezek a molekulák úgy illeszkednek a receptorokhoz, mint egy kulcs a zárba, ezáltal megakadályozva azok működését. Az EGFR-gátló kezeléseket többek között emlőrák, vastagbélrák, fej-nyaki daganatok, nem-kissejtes tüdőrák, petefészekrák és hasnyálmirigyrák esetén alkalmazzák.
Az EGFR-gátló terápiák hatékonysága
A klinikai vizsgálatok igazolták, hogy az EGFR gyógyszeres blokkolásával sikeresen leállíthatók azok a jelátviteli folyamatok, amelyek a tumorsejtek osztódását és növekedését serkentik. A kezelés sikeressége nagyban függ attól, hogy a páciens daganatsejtjeiben jelen van-e az EGFR gén mutáns formája. Amennyiben a gén nem mutálódott, az EGFR fehérje valószínűleg nem játszik kulcsszerepet a tumorsejtek proliferációjában.
Az EGFR gén állapotának meghatározására korszerű molekuláris diagnosztikai eljárásokat alkalmaznak. Ha a vizsgálatok igazolják a mutáció jelenlétét, a célzott terápiák akár kétszeresére is növelhetik a betegségmentes és teljes túlélési időt a hagyományos kezelésekhez képest.
A célzott terápiák és a teljes gyógyulás kapcsolata
A célzott gyógyszereket gyakran önállóan, de sok esetben a konvencionális kemoterápiával kombinálva alkalmazzák. Az onkológusok általában akkor beszélnek teljes gyógyulásról, ha a beteg a kezelés kezdetétől számított 5 év elteltével is tünetmentes és életben van. Mivel a célzott terápiákat sokszor más kezelésekkel együtt használják, nem lehet egyértelműen megállapítani, hogy önmagukban képesek-e teljes gyógyulást eredményezni.
Az azonban kijelenthető, hogy a célzott kezelések jelentősen javíthatják a teljes gyógyulás esélyeit, mivel a tumorsejtek gyakran gyorsan és látványosan reagálnak ezekre a modern terápiákra. Ez lehetővé teheti például olyan műtéti beavatkozások elvégzését, amelyek korábban nem voltak kivitelezhetők.
Az EGFR-gátló terápiákról ráktípusonként
EGFR és emlőrák
Az EGFR az egyik első azonosított fontos célpont az új típusú daganatellenes szerek között. A tripla-negatív emlőrák (TNBC) és a gyulladásos emlőrák (IBC) esetek körülbelül felében mutatható ki EGFR túlexpresszió.
A TNBC-ben az EGFR túlexpresszió aránya magasabb, mint más emlőrák altípusokban, ezért az EGFR-gátlók ígéretes terápiás lehetőséget jelentenek. Az EGFR-célzott terápia fokozhatja a TNBC sejtek kezdeti érzékenységét a citotoxikus kezelésre. Az erlotinib (EGFR-gátló) és doxorubicin (kemoterápiás szer) időben eltolt kombinációja fokozott sejtpusztulást eredményezett, amit közvetve az EGFR tartós gátlása okozott.
Az EGFR-pozitív IBC betegek 5 éves teljes túlélése rosszabb, mint az EGFR-negatív tumoroké. Az EGFR expresszió IBC-ben összefügg a kiújulás fokozott kockázatával. Mivel a hagyományos kemoterápia nem elégséges az IBC kezelésére, új terápiás lehetőségekre van szükség, amelyek közül az EGFR-gátlók ígéretesnek tűnnek.
EGFR és petefészekrák
Az előrehaladott petefészekrák prognózisa rendkívül kedvezőtlen, ezért intenzív kutatások folynak új célzott terápiák kifejlesztésére. Az EGFR túlexpressziója a petefészekrák esetek jelentős részében kimutatható. Bár nem minden esetben korrelál a betegség agresszivitásával, az EGFR expresszió összefügg a rossz prognózissal és a csökkent terápiás válaszkészséggel.
Az EGFR-gátlók két fő típusa a kis molekulájú tirozin-kináz inhibitorok (TKI) és a monoklonális antitestek. A leggyakrabban alkalmazott TKI az erlotinib, amely szelektíven és reverzibilisen gátolja az EGFR tirozin-kináz aktivitását. Sajnos a petefészekrákban végzett klinikai vizsgálatok eddig minimális hatékonyságot mutattak, ezért a jelenlegi kutatások a rezisztencia mechanizmusok feltárására és alternatív célzási módszerek kidolgozására összpontosítanak.
EGFR és hasnyálmirigyrák
A hasnyálmirigyrák a negyedik vezető daganatos halálok. Az EGFR család fontos szerepet játszik a hasnyálmirigy duktális karcinóma patogenezisében és agresszivitásában. Az EGFR aktiválódása elősegíti a sejtosztódást, az érképződést, az áttétképződést és csökkenti a programozott sejthalált.
Az erlotinib (EGFR-gátló) gemcitabinnel kombinálva kismértékű, de statisztikailag szignifikáns túlélési előnyt mutatott előrehaladott hasnyálmirigyrákban. Ez további kutatásokat ösztönzött az EGFR-célzott terápiák alkalmazására, bár az eredmények egyelőre csalódást keltőek. A rezisztencia kialakulása gyakori, ami korlátozza a hatékonyságot.
EGFR és vastagbélrák
A vastagbélrák-végbélrák (CRC, colorectal cancer) világszerte jelentős egészségügyi probléma, a betegek akár 50%-ánál alakulnak ki áttétek a betegség során. Az epidermális növekedési faktor receptor (EGFR) kulcsszerepet játszik a vastagbélrák és végbélrák patogenezisében, ezért intenzív kutatások folynak EGFR-gátló
Az EGFR-gén túlszabályozása a vastag- és végbélbélrákos betegek 60-80%-ában kimutatható. Különböző gyógyszereket fejlesztettek az EGFR túlzott működésének gátlására, ezek közül a Cetuximab és a Panitumumab törzskönyvezett vastag és végbéldaganatos betegek esetében. Ezek monoklonális ellenanyagok, amelyek a receptor sejtfelszíni részéhez kötődnek anélkül, hogy aktiválnák a receptort és az arról induló jelutat. A kötõdés a jelátvitel blokkolásához, a tumornövekedés gátlásához és apoptózishoz vezet.
Vastagbél és végbéldaganatok esetében azonban az EGFR-elváltozásokat nehéz vizsgálni, prediktív szerepük nem tisztázott. Ezzel szemben az EGFR jel továbbításában résztvevő RAS fehérjék (KRAS és NRAS) klinikai szerepe egyértelműen bizonyított. Egészséges sejtben, ha a KRAS megfelelően működik, a sejtek csak akkor növekednek és osztódnak, ha szükséges. A KRAS meghibásodása, mutációja esetén azonban a sejtek folyamatosan osztódnak, függetlenül az EGFR státusztól. Ezért EGFR-célzott terápiák csak vad típusú KRAS- és NRAS-génekkel rendelkező betegeknek adhatók kemoterápiával kombinálva vagy önmagukban, meghatározott kezelések sikertelensége után.
EGFR célpont a fej-nyaki daganatokban
A fej-nyaki laphámsejtes karcinóma a hatodik leggyakoribb daganattípus világszerte, évente körülbelül 600 000 új esetet diagnosztizálnak. Az EGFR az egyetlen nem-kemoterápiás molekuláris célpont, amelynek gátlása klinikailag hatékonynak bizonyult ebben a daganattípusban
A fej-nyaki daganatok több mint 90%-ában kimutatható EGFR túlexpresszió, ami vonzó terápiás célponttá teszi. A fokozott EGFR fehérje expresszió vagy EGFR gén kópiaszám amplifikáció összefügg a rossz prognózissal. Jelenleg az egyetlen jóváhagyott célzott terápia fej-nyaki daganatokban a cetuximab, ami egy monoklonális antitest az EGFR ellen.
EGFR-gátlás a nem-kissejtes tüdőrák esetében
A nem-kissejtes tüdőrák (NSCLC) a vezető daganatos halálok mind a férfiak, mind a nők körében. Az NSCLC-s betegek körülbelül 30%-ánál Kelet-Ázsiában és 10-15%-ánál a nyugati országokban EGFR mutáció mutatható ki. Ebben a betegcsoportban az első vonalbeli kezelésként EGFR tirozin-kináz inhibitorok (erlotinib, gefitinib vagy afatinib) alkalmazása javasolt.
Mind az Európai Orvosi Onkológiai Társaság (ESMO), mind az Amerikai Mellkasi Orvosok Kollégiuma (ACCP) első vonalbeli TKI (erlotinib vagy gefitinib) kezelést javasol EGFR-mutációt hordozó metasztatikus NSCLC-ben, mivel magasabb válaszarányt, hosszabb progressziómentes túlélést és jobb életminőséget eredményez, mint az első vonalbeli kemoterápia. Az erlotinib és a gefitinib csak az EGFR-1-es receptorokra hatnak és reverzibilisen gátolják azokban a tirozinkinázt. A daganat azonban idővel ellenállóvá válhat velük szemben. Ezért úgynevezett második generációs EGFR gátlókat is kifejlesztettek, ezek közé tartozik az afatinib tirozinkináz gátló is. Az afatinib már nem csak a tirozinkináz aktivációját gátolja, hanem az aktivált enzim működését is. Az EGFR receptorcsalád három tagjára is hat, és a gátlása irreverzibilis, aminek köszönhetően a terápiás hatás hosszabb ideig fennáll.
A TKI inhibitorokat használva egy idő után ezek elveszthetik hatékonyságukat, melynek hátterében legtöbbször rezisztencia mutáció megjelenése áll. A leggyakoribb rezisztencia mutáció a T790M , ami közel 60%-ban jelentkezik. A mutáció jelenlétében az EGFR fehérje térszerkezete megváltozik, ami az erlotinib/gefitinib kötődését nagyon lecsökkenti.
Az Osimertinib a T790M mutációval rendelkező EGFR gátlására lett kifejlesztve, úgynevezett mutációszelektív harmadik generációs EGFR gátló. Előnye, hogy irreverzibilisen gátolja a T790M mutáns EGFR receptort is, míg a normál EGFR-hez alig kötődik. Az Osimertinib magában és kemoterápiában is adható EGFR mutációt hordozó nem-kissejtes tüdődaganatos betegek részére.
Az EGFR-gátló terápiák a célzott daganatkezelés fontos eszközei, amelyek több daganattípusban is hatékonynak bizonyultak. Bár még számos kihívással kell szembenézni, például a rezisztencia kialakulásával, megfelelő molekuláris célpont jelenléte esetén az EGFR-gátlók alkalmazása jelentősen hozzájárulhat a rákbetegek életkilátásainak javításához. A fentebb felsorolt ráktípusokban ma már Magyarországon is rutinszerűen vizsgálják az EGFR génexpresszió intenzitását.
Megosztás
Pácienseink visszajelzései
Minden betegség váratlanul tör az embere, de a rák még alattomosan is, hiszen csak az utolsó pillanatban érzi valaki, hogy baj van. Ilyenkor a döbbenet után azonnal lépni kell, minél gyorsabban haladni azon az úton – amely elvezethet a gyógyuláshoz. Az idő ilyenkor mindennél fontosabbá válik. Ebben kaptam én segítő kezet az Istenhegyi Magánklinikán, ahol az első konzultációm után két nappal már túl vagyok a mammográfián, az ultrahangos vizsgálaton és a cytológián is. És ebben nem csak a profi orvosok teljesítettek maximálisan, de az intézmény munkáját segítő hölgyek is mindenben segítették utamat vizsgálatról-vizsgálatra. Most már csak az eredményre várok, hogy a következő konzultáción kijelöljék a következő időszak teendőt. Köszönettel tartozom mindenkinek.
Update:
A rák az a betegség amely mindenkit elérhet-és ha rátalál, prófétává teszi. A saját tapasztalatát igyekszik megosztani hasonló sorstársaival. Én 30 nappal ezelőtt fordultam az Istenhegyi klinika szakembereihez – a kapcsolattartó hölgyek gyors segítségével – és ma már az összes meghatározóan fontos lelettel a kezemben készülök a gyógyítás megkezdésére. Senki ne várjon, keresse az első gyanús jelre a klinika specialistáit, hiszen életmentő lehet a kúra gyors elkezdése. Szerencsém van, lehet hogy sikerül megakadályozni a férfiaknál ritka melldaganat terjedését.
Maximálisan elégedett vagyok a kapott szolgáltatással! Segítőkész, intelligens, emberséges személyzet. Mindenképp népszerűsíteni fogom a klinikát a lehető legszélesebb körben!
Dr. Landherr László tanár úr, nagyon kedves volt, szakmai tudása lenyűgöző és a kérdés amivel mentem arra kiváló tájékoztatást kaptam és így a segítségével már tudom mit kell tegyek.
Maximális teljesítmény_ hozzáértés a klinika részéről _ egyedi _magasfokú felkészültség és hozzáértés Várkonyi Rita részéről! Köszönöm szépen mindenkinek !
Kiváló szakemberek, nagyszerű szervezés, empatikus hozzáállás, mindenkinek ajánlható!
Tiszta, rendezett rendelő, időben történt a behívás. A kezelő orvos érthetően elmagyarázott mindent, az asszisztens is segítőkész volt. Ritka a mai világban…..csak ajánlani tudom.
Hálásan köszönöm a kiemelkedően gyors kivizsgálásokat, melyeknek köszönhetően az első ultrahangot követően szűk 1 héten belül minden – az onkológiai konzultációhoz szükséges – lelet a kezemben volt a diagnózissal együtt. Az orvosok szakmai tapasztalata és segítőkészsége hatalmas segítség ebben a helyzetben.
A netes időpont foglalástól a pontos és kedves szakrendelésig maradéktalanul elégedett voltam. Rend, tisztaság és jó megközelíthetőség csak hozzátesz.
Áraink
Megbízható laboratóriumi háttér
Klinikánk molekuláris diagnosztikai partnere a budapesti székhelyű Eurofins Medserv szövettani laboratórium, az Eurofins Scientific nemzetközi laboratóriumi hálózat tagja. A Eurofins Scientific cégcsoport több mint 44 országban van jelen, a világ egyik vezető laboratóriumi hálózata élelmiszer-biztonság, környezetvédelem, klinikai diagnosztika és gyógyszerkutatás terén.
Páciensek szövetmintáinak szekvenálását és annak molekuláris diagnosztikai elemzését a hálózathoz tartozó spanyolországi Eurofins Megalab végzi, garantálva a legmagasabb színvonalú technikai hátteret, elemzési módszereket és szakértelmet.
Az Eurofins Megalab több mint 30 éves tapasztalattal rendelkezik klinikai diagnosztika, molekuláris biológia, genetikai és patológiai elemzések terén. Európa egyik legnagyobb laboratóriumi hálózatát üzemelteti, több mint 5,000 különböző vizsgálattal, évente 50 millió elvégzett analízissel, több mint 700 egészségügyi szakember munkájának segítségével, biztosítva a lehető legmagasabb szintű szakértelmet és szolgáltatást. A labor szorosan együttműködik kórházakkal és klinikákkal: az eredmények kiértékelésén és azok értelmezésén multidiszciplináris csapat dolgozik, patológusok, molekuláris biológusok, genetikusok segítik az onkológusok munkáját.